DIAGNOSTICO DE ENFERMEDAD ARTERIAL PERIFÉRICA
ENFERMEDAD ARTERIAL PERIFÉRCIA, ¿DE QUÉ ESTAMOS HABLANDO?
La enfermedad arterial periférica (EAP), puede llevar a la obstrucción de las arterias periféricas, puede presentar síntomas comunes como dolor, claudicación intermitente o como sucede en la mayoría de los casos, pasar desapercibida. La isquemia crónica que amenaza las extremidades es la etapa final de la enfermedad arterial periférica (EAP). Esta enfermedad causa muchas pérdidas de extremidades, dolor y disminución de la calidad de vida(1). La mayoría de pacientes con EAP presentan enfermedad aterosclerótica de la extremidad inferior(2).
Durante mucho tiempo se utilizaron muchos nombres para nombrar la enfermedad oclusiva de las extremidades inferiores, en términos generales el término Enfermedad Arterial Periférica (EAP) se considera el término general que abarca una serie de síndromes arteriales no coronarios causados por la estructura y función de las arterias alteradas de la aorta y las arterias periféricas debido a diferentes procesos fisiopatológicos (2).
¿QUÉ LA CAUSA?
La aterosclerosis es la principal causa de la EAP (3)
MANIFESTACIONES CLÍNICAS
La mayoría de los pacientes con EAP son asintomáticos, y los que presentan síntomas dependen del número de arterias estrechadas y de la gravedad de la estrechez de estas. Los síntomas pueden variar dependiendo del grupo muscular afectado, pudiendo ser tan leve como para pasar inadvertido, pasar por dolor al ejercicio, luego al reposo y por último presentar úlceras arteriales. El American College of Cardiology/American Heart Association (ACC/AHA) de EAP sugiere la siguiente distribución de la presentación clínica de la EAP en pacientes mayores de 50 años (2):
- Asintomático 20-50%
- Dolor atípico en las piernas 40-50%
- Claudicación clásica 10-35%
- Miembro amenazado 1-2%
Es muy importante identificar los pacientes con mayor riesgo, que a nuestro entender son los pacientes que no presentan síntomas, ya que no es posible tratar lo que no se sabe que está ahí, y de esa forma la enfermedad progresará hasta llevar a infartos, accidentes cerebro vasculares o amputación de algún miembro.
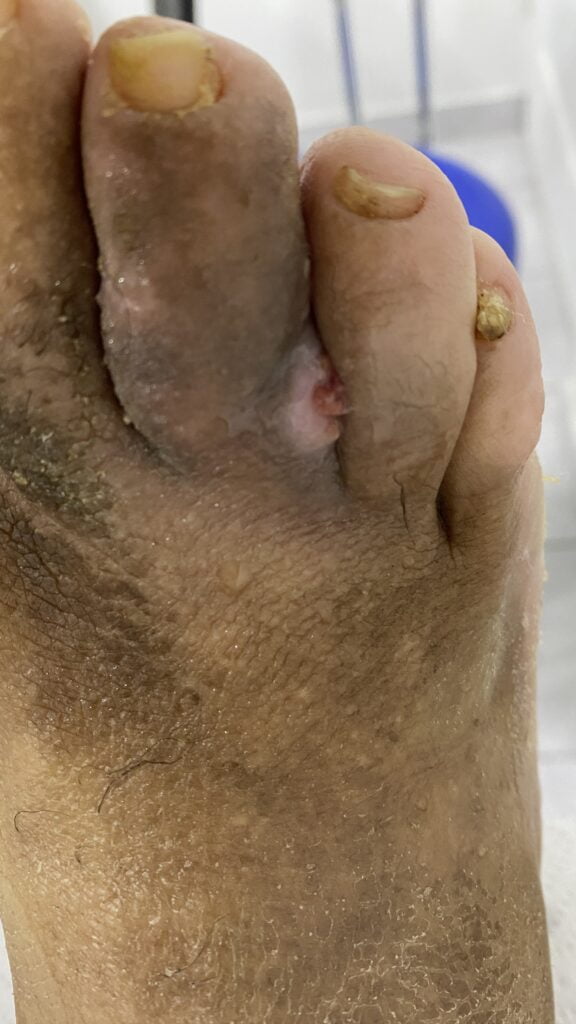
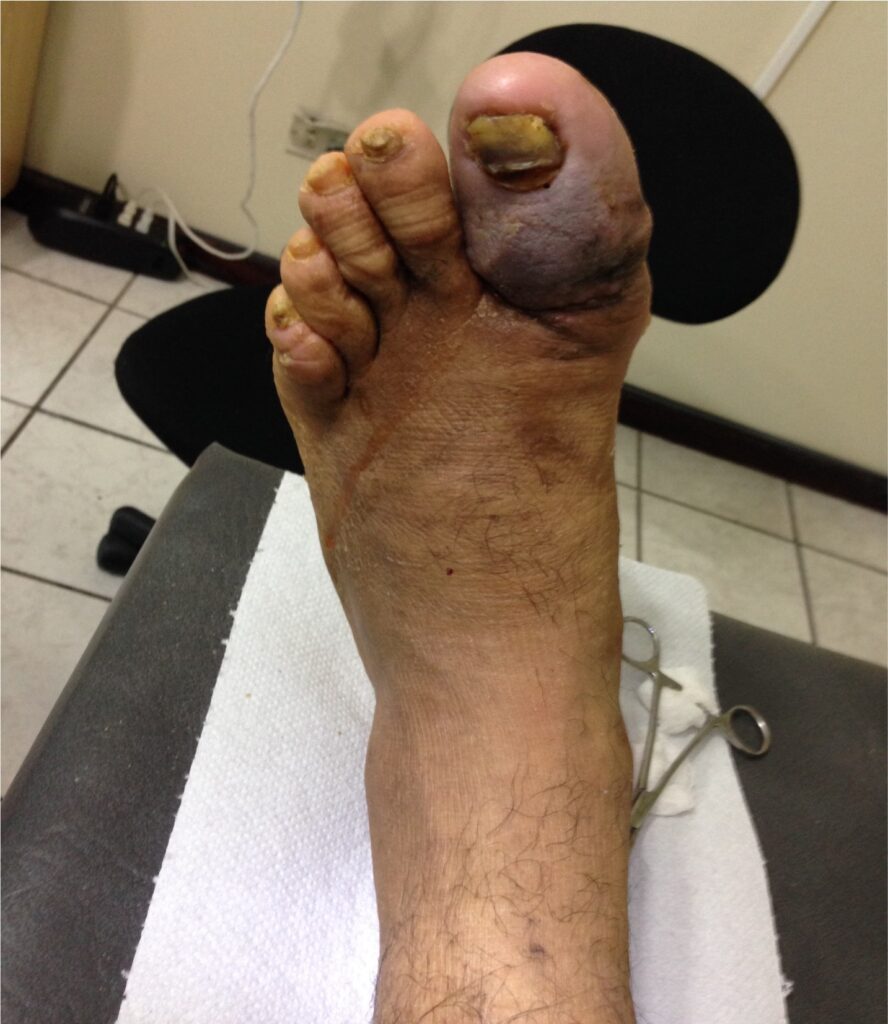
La isquemia suficiente para amenazar la extremindad se produce cuando el flujo sanguíneo arterial es insuficiente para satisfacer las demandas mentabólicas del músculo o del tejido en reposo, pudiendo presentar diversos grados de pérdida de tejido, necrosis o péridida de dedos o de pie.
ISQUEMIA CRÍTICA QUE AMENAZA LA EXTREMIDAD
El término “Isquemia crítica que amenza la extremidad” está desactualizado debido a que no logra abarcar el espectro completo de pacientes con esta enfermedad, en su lugar se propone el término “Isquemia crónica que amenaza las extremidades” (ICAM), para de esta forma incluir un número más grande y heterogéneo de pacientes con diversos grados de isquemia que a menudo puede retrazar la cicatrización de heridas y aumentar el riesgo de amputación (4). Los pacientes con isquemia crónica que amenaza la extremidad deben definirse principalmente en términos de la presentación clínica, complementada con estudios fisiológicos que demuestren el grado de iquemia.
¿CÓMO HACEMOS EL DIAGNÓSTICO?
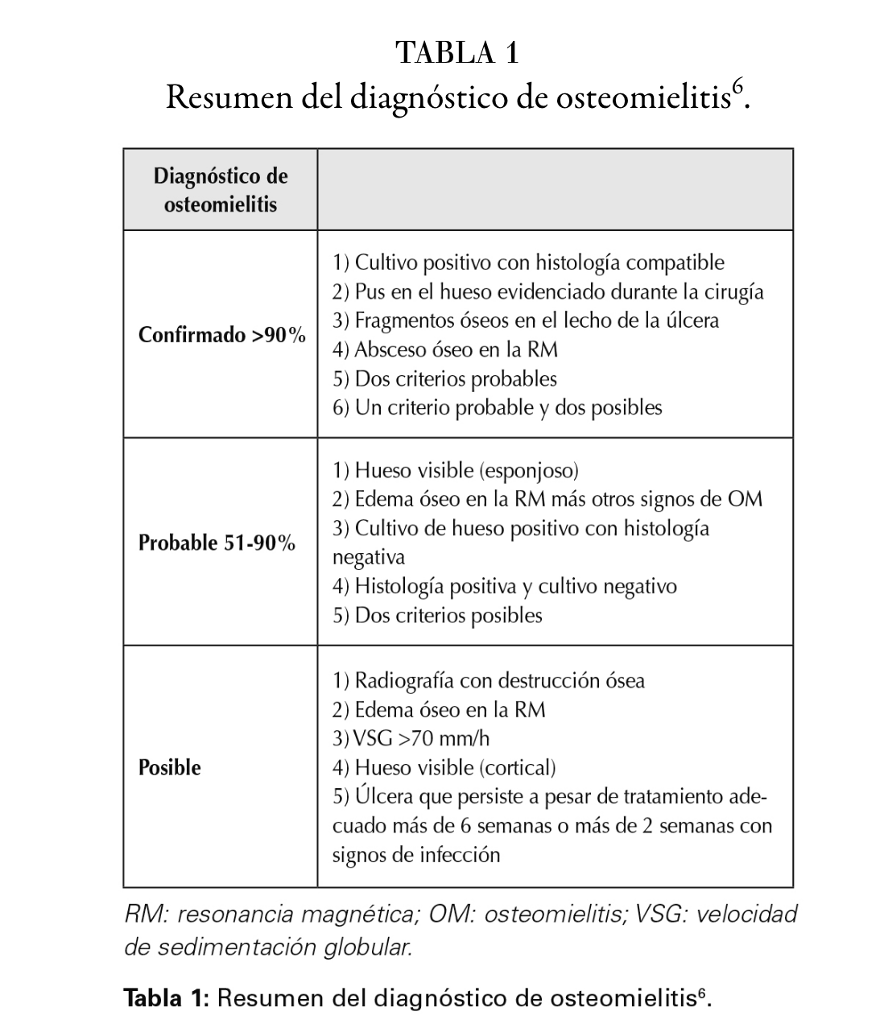
Los parémetros anormales para el diagnóstico son: índice tobillo brazo (ITB) <0.4 (usando la medición más alta de las arteria pedia o tibial posterior), presión transcutánea de oxígeno <30 mmHg, ondas de pulso planas o mínimamente pulsátiles, presión en halux menor de 30 mmHg o índice dedo brazo (IDB) <0.3. Tanto la historia clínica como la exploración física tienen poco valor diagnóstico, debido a que su sensibilidad es muy baja, y se considera que en pacientes no diabéticos el ITB es es estudio con mejor rendimiento diagnsotico con una sensibilidad de entre 70 a 90% (5). La especificidad de ITB bajo para coronariopatia, ictus y mortalidad cardiovascular fue del 92.7%, 92.2% y 87.9% respectivamente(6).
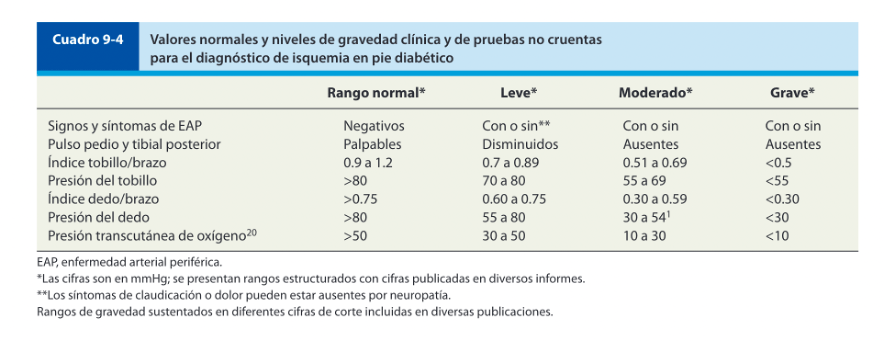
Tomado de (7)
El diagnostico de la EAP debe ser escalonado, comenzando por lo más básico que sería la palpación de pulsos hasta llegar a la platismografía arterial del pie. En ningún momento el doppler arterial como tradicionalmente lo conocemos puede hacer diagnóstico de isquemia por lo que su solicitud en estos pacientes debería ser abolida, al menos con el propósito de diagnosticar isquemia.
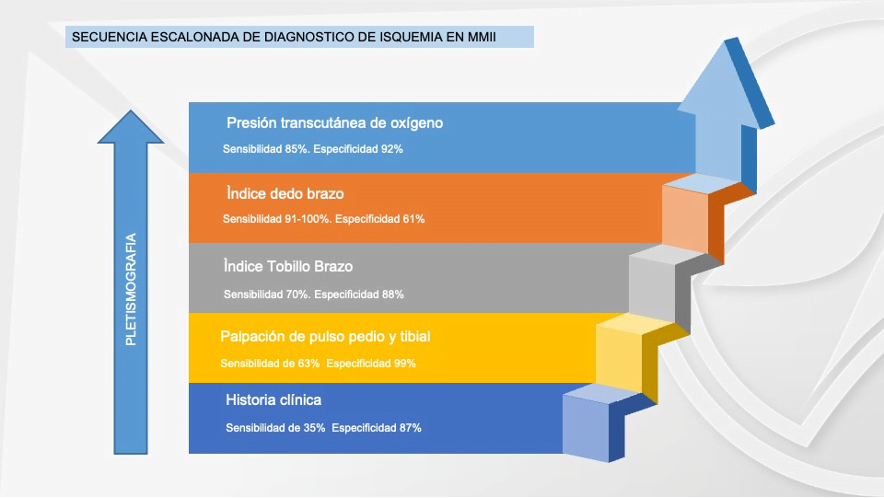
La sensibilidad y especificidad de las pruebas para detectar la EAP, nótese que no es mencionado el doppler arterial como estudio diagnostico para isquemia. Adaptado de (7)
ÍNDICE DEDO BRAZO
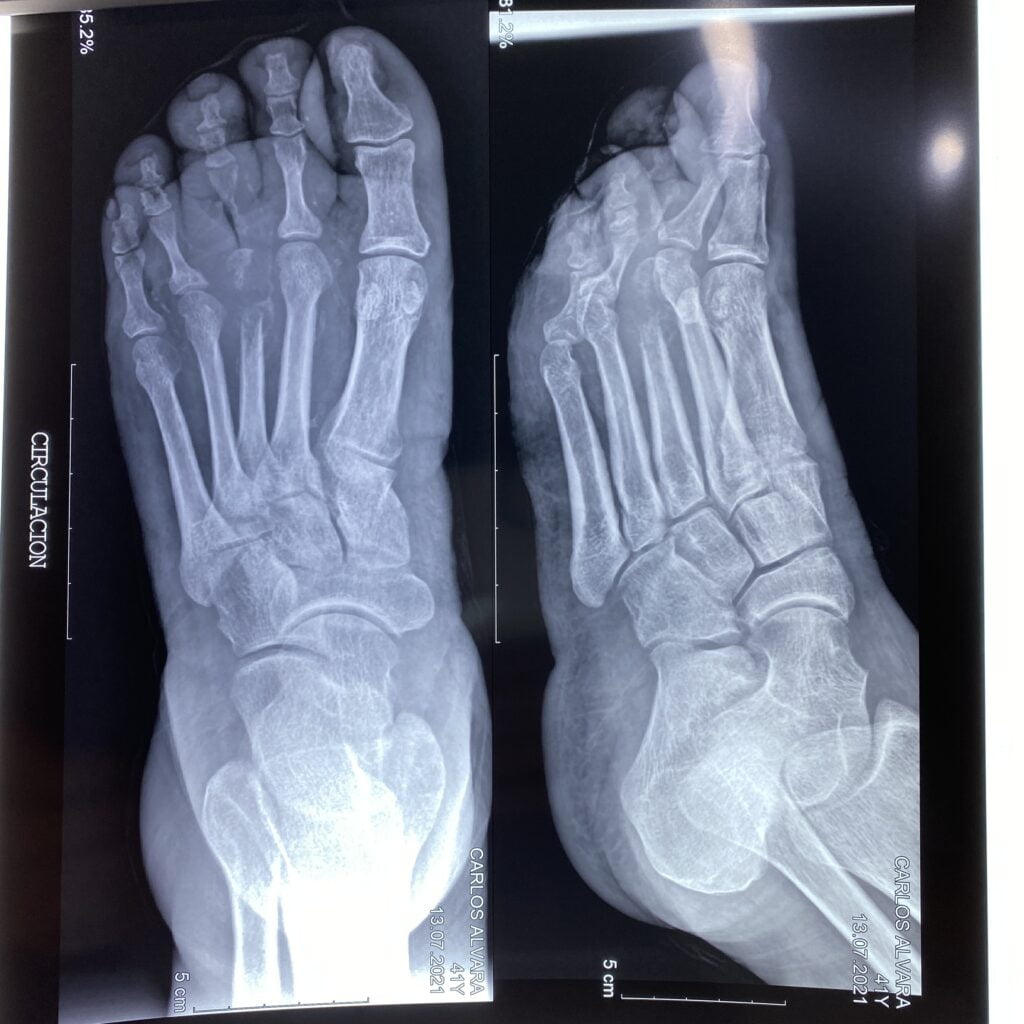
En el caso de los pacientes diabéticos, el ITB tiene baja sensibilidad debido a la calcificación de las arterias, lo que puede dar un ITB normal o incluso alto. Por lo anterior se considera como opción al IDB. Las arterias de pequeño calibre son menos suceptibles a la calcificación, por lo que brinda presiones reales, lo que le da más alta sensibilidad al estudio, pudiendo diagnosticar el EAP en todas sus etapas, incluso en diabéticos.
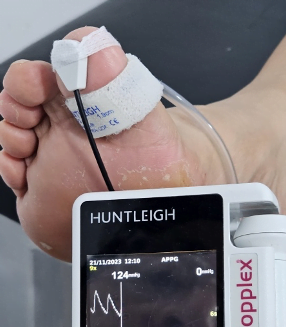
Paciente con presiones en dedo normales. Fuente propia
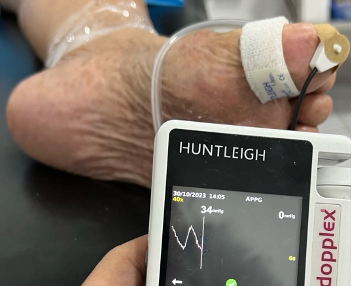
Paciente con presión en dedo que demuestra isquemia. Nótese que el paciente no tiene evidencia clínica de la isquemia.
En conclusión, la medición del índice dedo brazo con la pletismografía son el estudio mas certero para hacer diagnostico de EAP, incluso en diabéticos, en los cuales es mandatorio realizar el diagnóstico lo más temprano posible.
Bibliografía
1. Enfermedad Arterial periférica unido.pdf.
2. Mendoza OAG. Características clínicas y diagnóstico de la enfermedad arterial periférica de las extremidades inferiores – UpToDate.
3. Weitz JI, Byrne J, Clagett GP, Farkouh ME, Porter JM, Sackett DL, et al. Diagnosis and Treatment of Chronic Arterial Insufficiency of the Lower Extremities: A Critical Review.
4. Conte MS, Bradbury AW, Kolh P, White JV, Dick F, Fitridge R, et al. Global vascular guidelines on the management of chronic limb-threatening ischemia. J Vasc Surg [Internet]. junio de 2019 [citado 23 de agosto de 2022];69(6):3S-125S.e40. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0741521419303210
5. Metodos diagnosticos de EAP indice tobillo brazo.pdf [Internet]. [citado 10 de julio de 2022]. Disponible en: https://documentcloud.adobe.com/gsuiteintegration/index.html?state=%7B%22ids%22%3A%5B%221ObppJTGyuS6tQfVPnOU3YEN6aNkUm0bz%22%5D%2C%22action%22%3A%22open%22%2C%22userId%22%3A%22112469716077531484876%22%2C%22resourceKeys%22%3A%7B%7D%7D
6. guia-consenso-enfermedad-arterial-periferica.pdf.
7. Fermín Rafael Martínez de Jesús. Pie diabético: atención integral [Internet]. 2010 [citado 21 de agosto de 2022]. Disponible en: http://www.ebooks7-24.com/?il=958