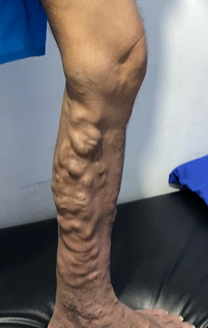
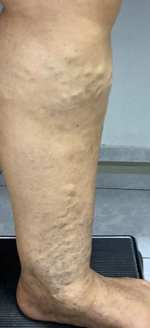
ATAQUE AGUDO ISQUÉMICO DE PIE DIABÉTICO
ATAQUE AGUDO ISQUÉMICO DE PIE DIABÉTICO
A PROPÓSITO DE UN CASO.
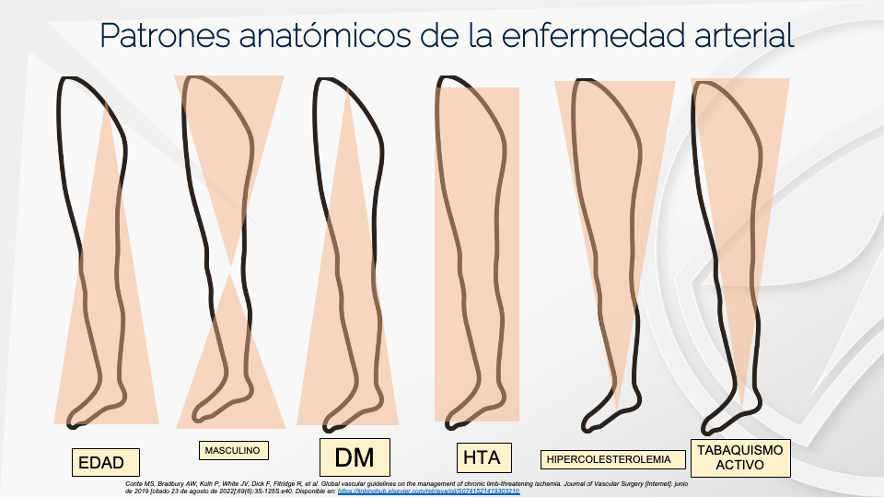
La diabetes Mellitus (DM), es una enfermedad con alta prevalencia en el mundo, la cual se ha duplicado desde 2014 y ha pasado de 4.7% a 8.5% en la población adulta(1). Una de sus complicaciones más temidas son las úlceras en el pie, siendo las más frecuentas las neuro isquémicas de un 46% a 65% (2). El riesgo de amputación en un diabético es 28 veces más alto que en los no diabéticos(2).
El pie diabético puede clasificarse según la clasificación WIFI.
El ataque al pie diabético tiene una presentación aguda y grave que representa una amenaza para la conservación del miembro afectado, y surge mediante la necesidad de identificar pacientes que necesiten intervención urgente, ya que, por su condición o gravedad e inminente empeoramiento, tiene un mal pronóstico si no es atendido y tratado en forma rápida. Existen tres tipos de intervención urgente: ataque de pie diabético infectado, ataque de pie diabético isquémico y neuropatía de Charcot en fase aguda(3). El ataque de pie diabético (APD) hace énfasis en las “horas de oro”, en referencia a la importancia de las primeras horas para el tratamiento de estos pacientes. El diagnóstico temprano de la isquemia y la infección son parte importante del éxito del tratamiento del pie diabético, los estudios han demostrado peores resultados en pacientes con isquemia en infección combinados(4). El ataque agudo al pie isquémico es crucial para lograr evitar las amputaciones mayores. En el presente artículo presentamos el caso de dos pacientes con ataque agudo isquémico e infeccioso combinados.
OBJETIVO
Describir la evolución de dos pacientes con pie isquémico e infeccioso mediante la actuación temprana.
PRESENTACIÓN DE CASO
CASO
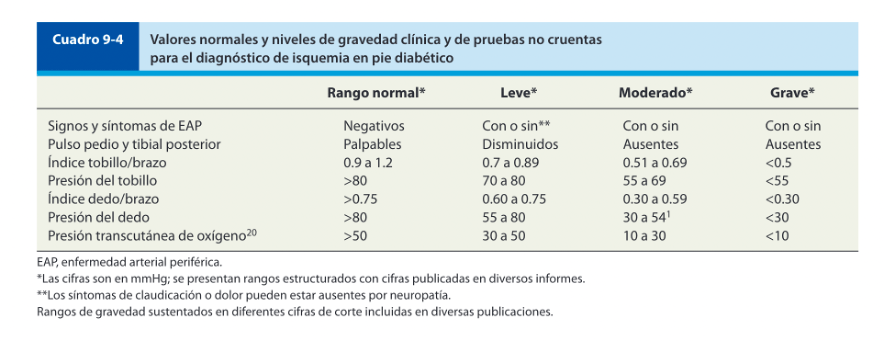
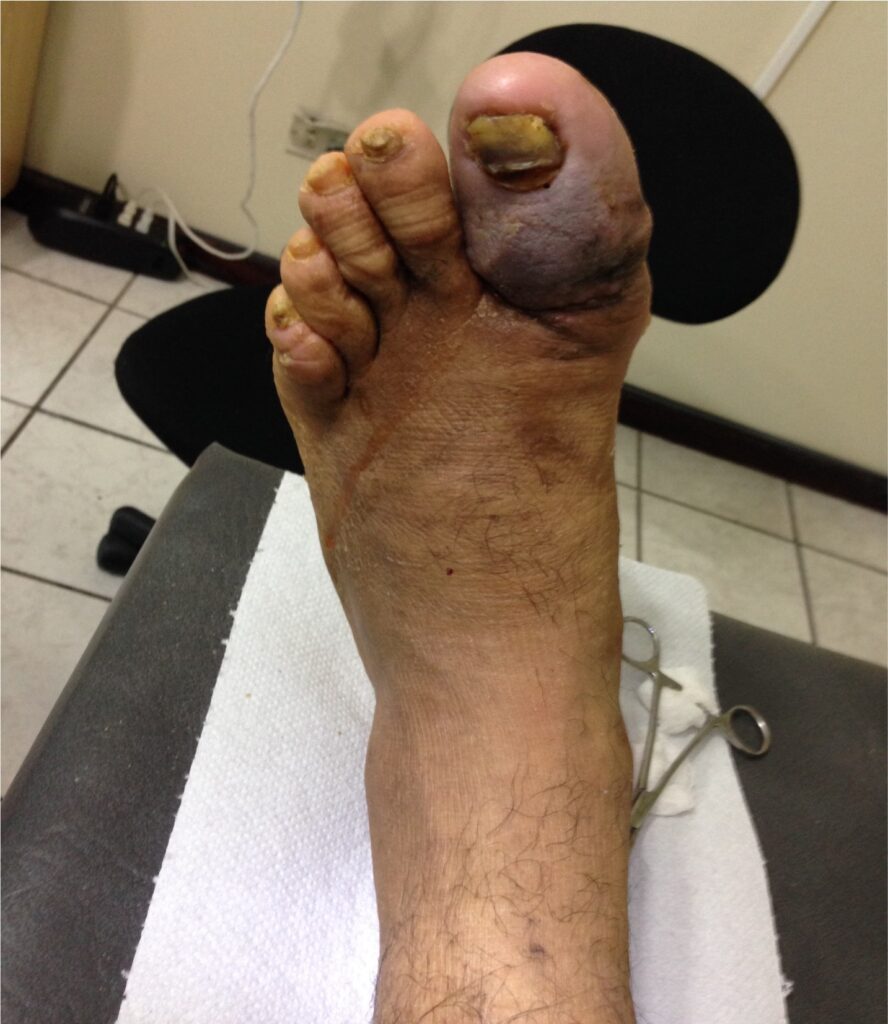
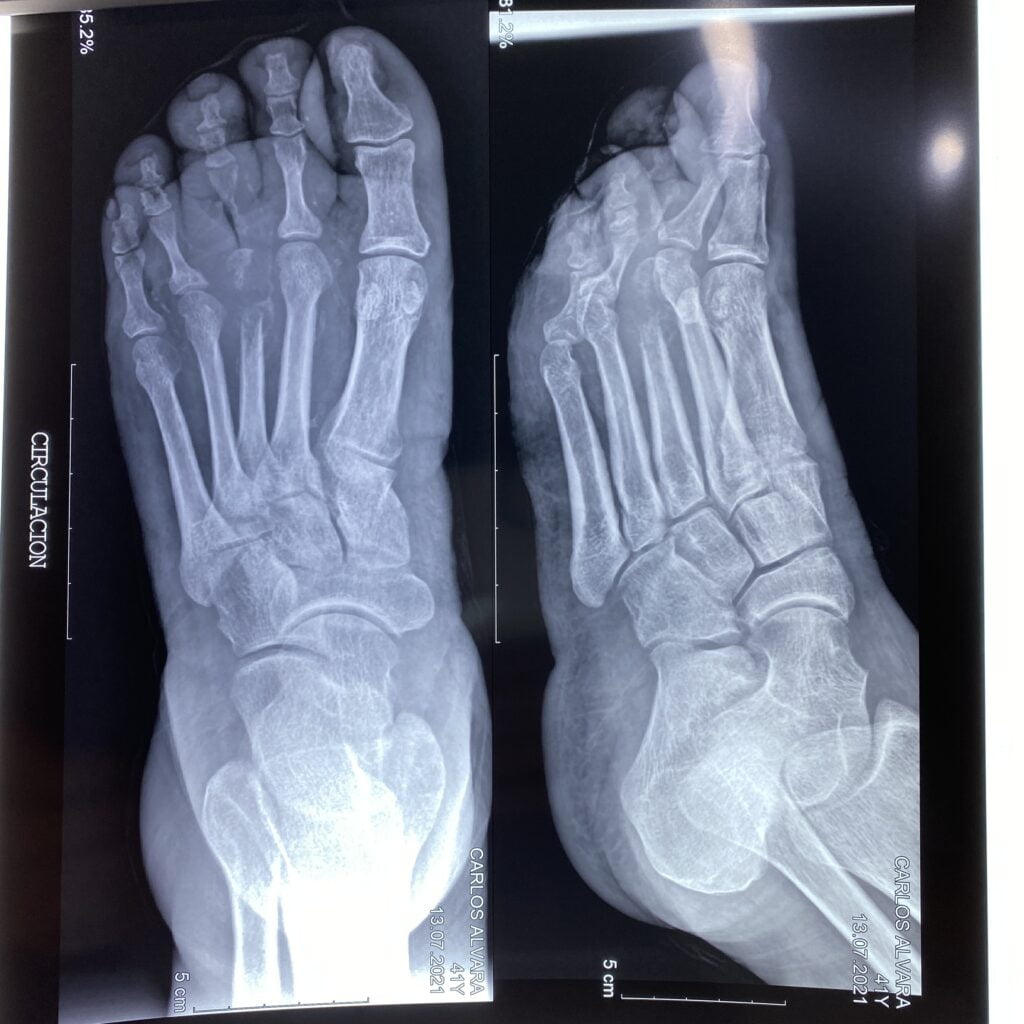
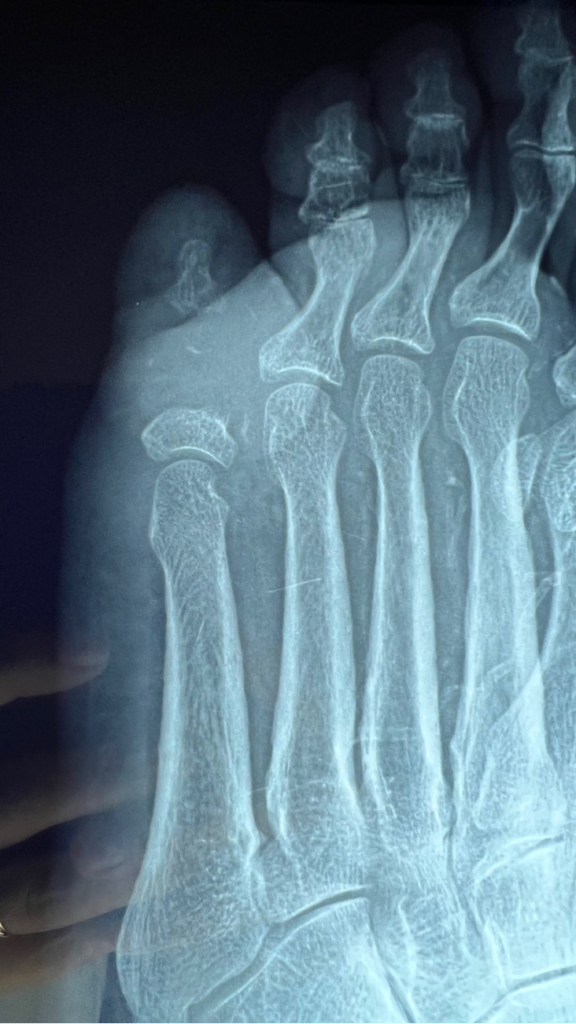
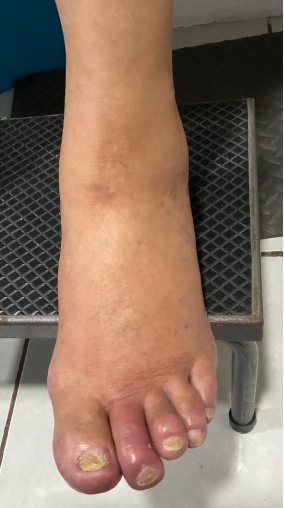
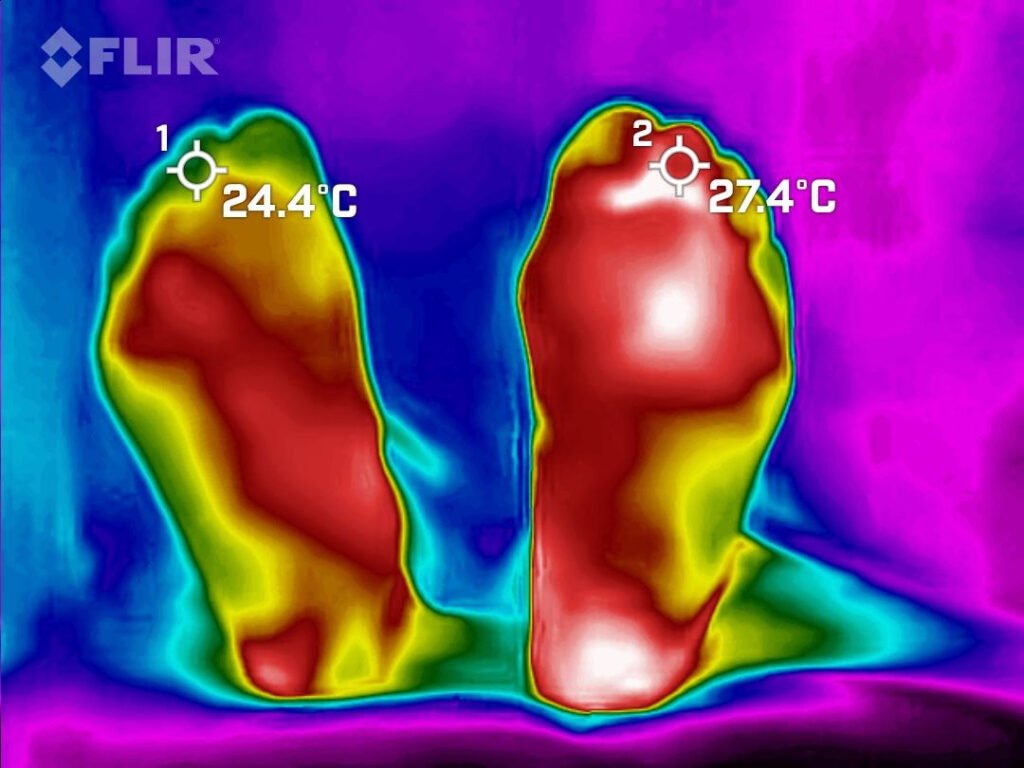
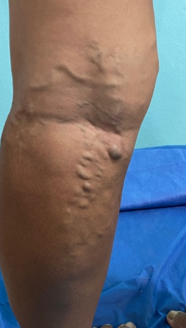
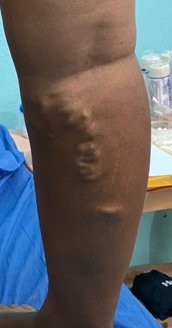
Mujer de 62 años con historia de 20 años de ser diabética e hipertensa, tratada con metformina 850 mg cada 12 horas, mas balsartan. Tiene historia de 10 días de haber sufrido trauma mientras caminaba en el mercado, “un tropezón”. Una semana después lo nota negro y comienza con fiebre, fue manejada con Ceftriaxona IM, al parecer sin mejoría. Es evaluada nuevamente y presenta eritema hasta tercio medio de pierna y necrosis distal en hálux derecho. Glóbulos blancos de 15,000 y 70% de neutrófilos, glucosa capilar de 400. Es referida a la clínica y se corroboran los hallazgos de necrosis en la falange distal del hálux, más eritema hasta pie, y se le toma índice dedo brazo de 0.07, y presión en el hálux de 11 mmHg, WIFI con alta probabilidad de perder el miembro y reacción inflamatoria sistémica (RIS). Se diagnostica como isquemia crítica por lo que se ingresa a hospital para revascularización.
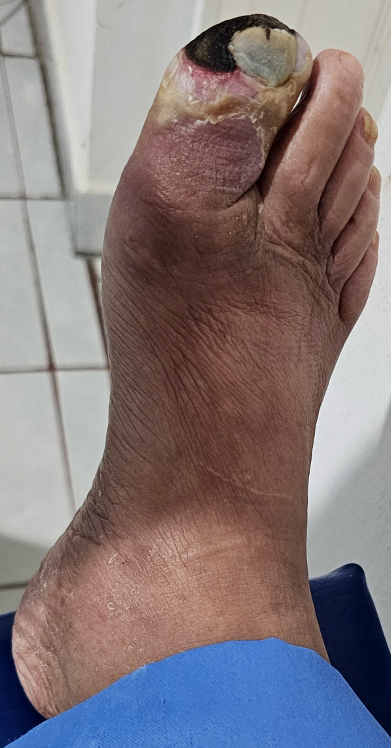
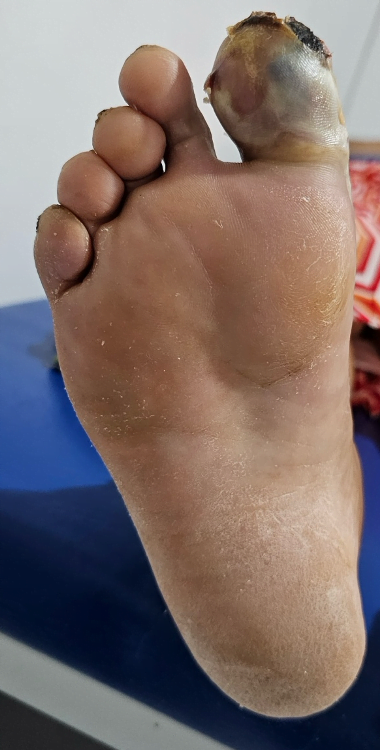
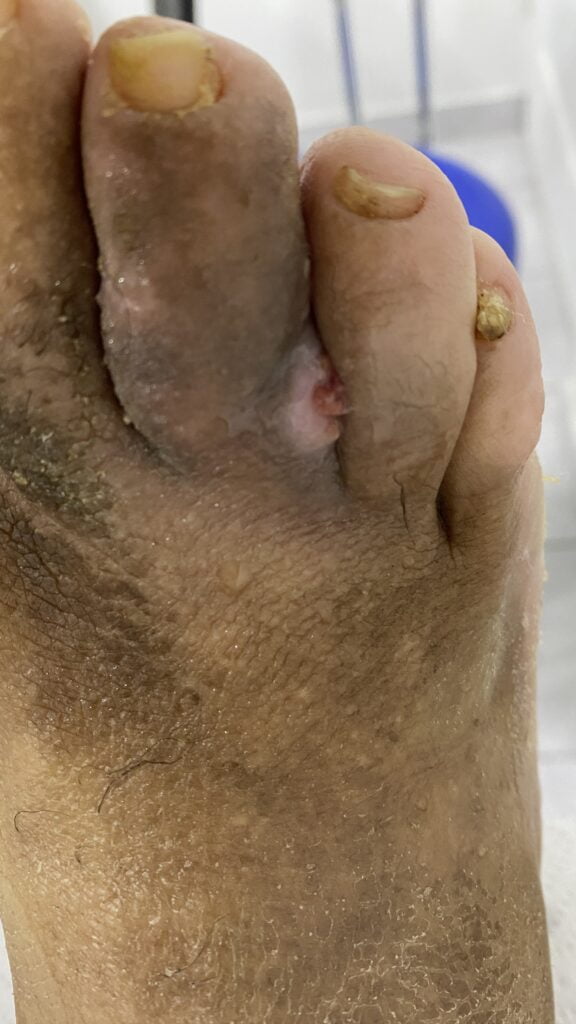
Fig. 1. Vista dorsal y plantar del pie de la paciente al momento de la consulta (fuente propia)
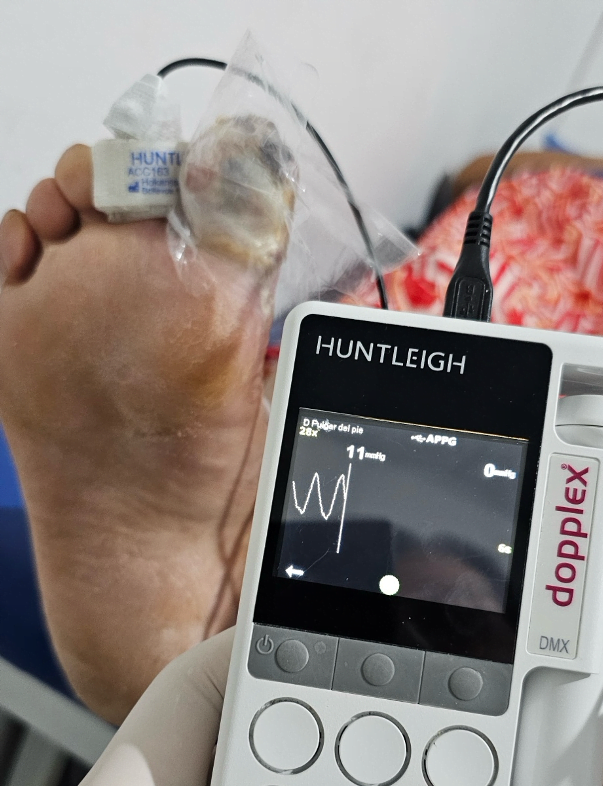
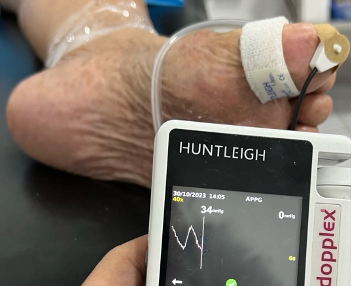
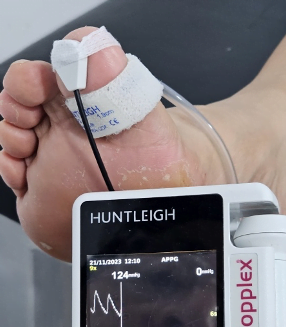
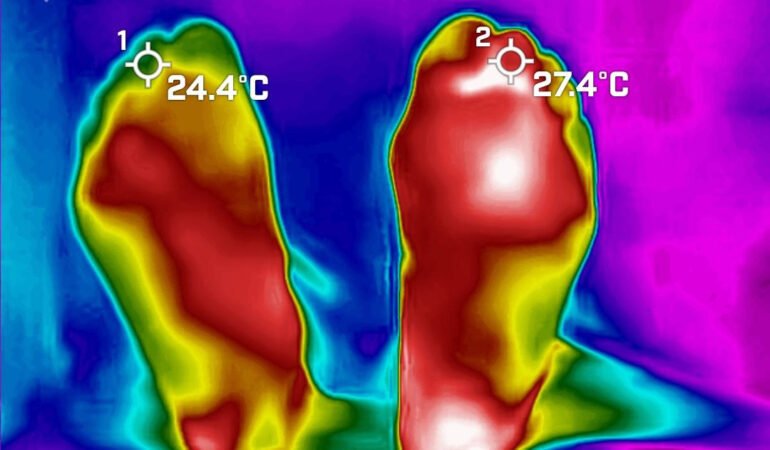
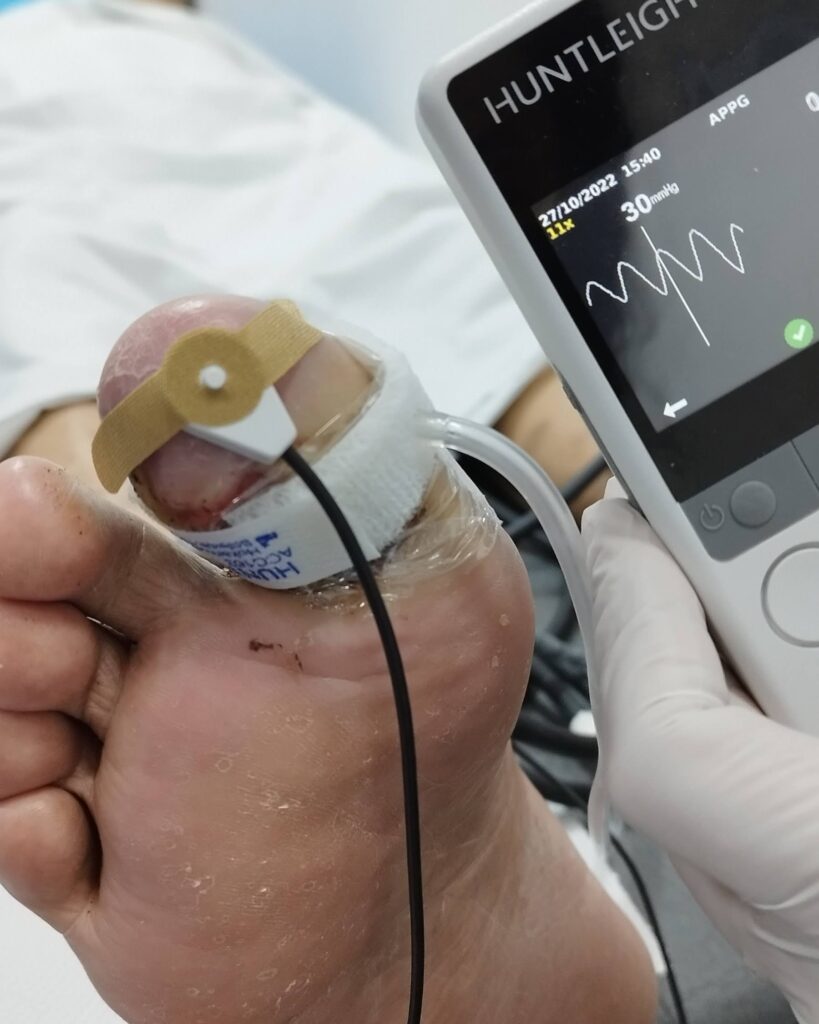
Fig. 2 Presión en segundo dedo de 11 mmHg (fuente propia)
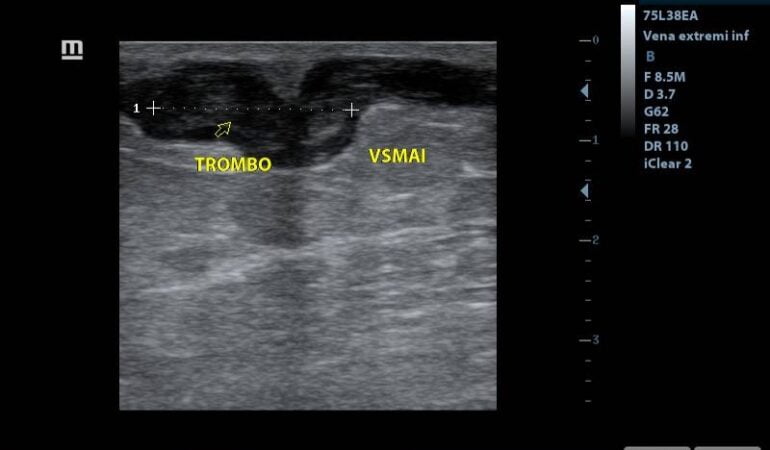
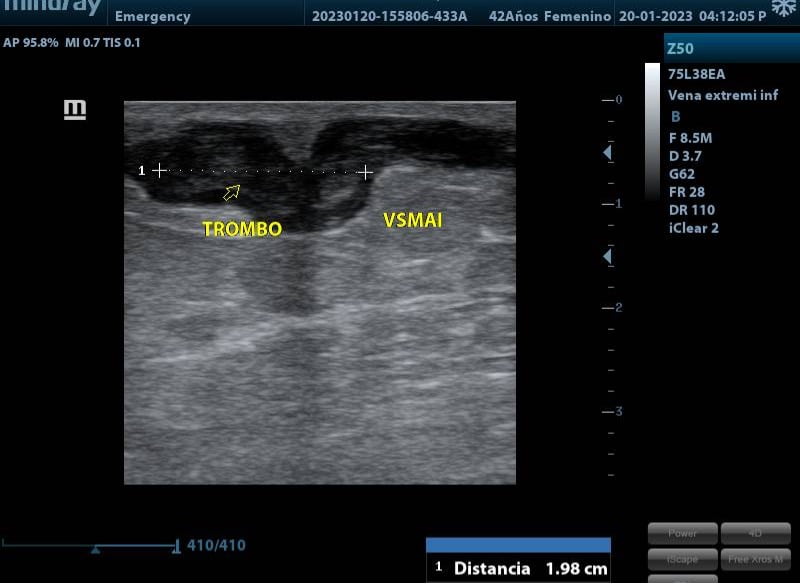
Al realizar la arteriografía diagnóstica y terapeútica el cirujano vascular reporta obstrucción a nivel del 1/3 medio de la AFS y a nivel de la A. Tibial Anterior. Por lo que se procede a realizar el procedimiento de revascularización. Inmediatamente posterior a la revascularización el ortopeda procede a retirar el hálux infectado.
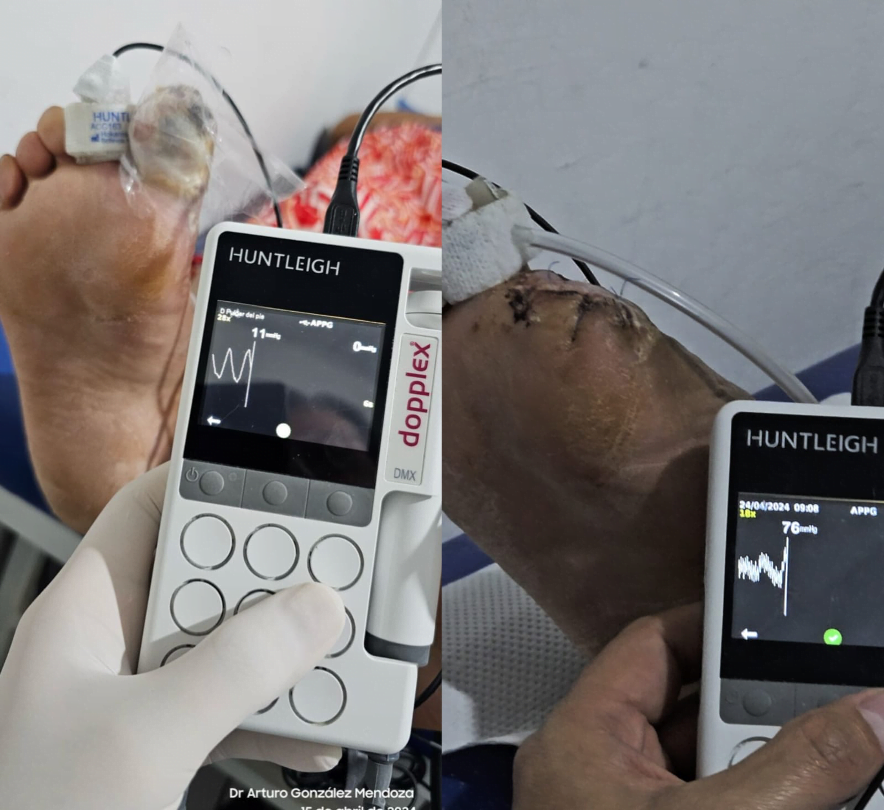
Fig 3. Podemos observar la presión en el segundo dedo, antes y después del procedimiento de revascularización.
Discusión:
La decisión de la revascularización en pacientes sin úlcera depende de la severidad de los síntomas, la claudicación o si se les imposibilita realizar las actividades de la vida diaria, si ha fallado el tratamiento médico o si presenta enfermedades que dificulten el ejercicio físico(5). Pero en el caso de tener una úlcera, la isquemia se vuelve crítica y es necesario pensar en la revascularización de inmediato.
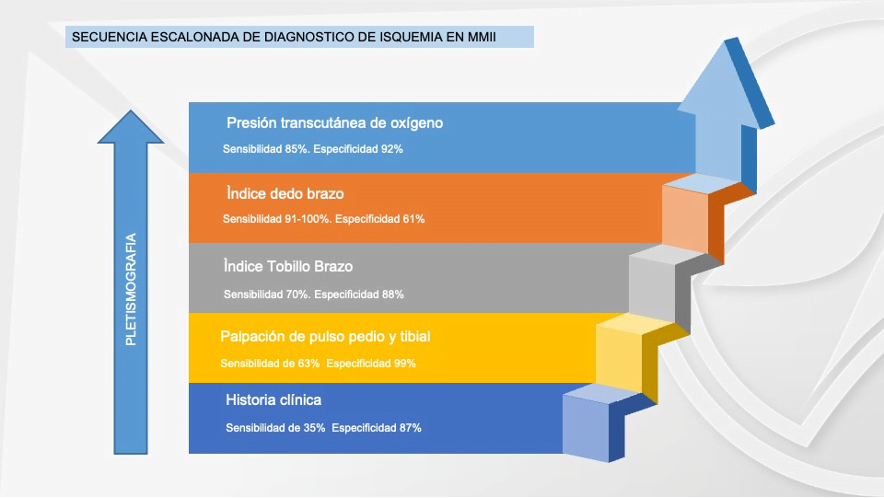
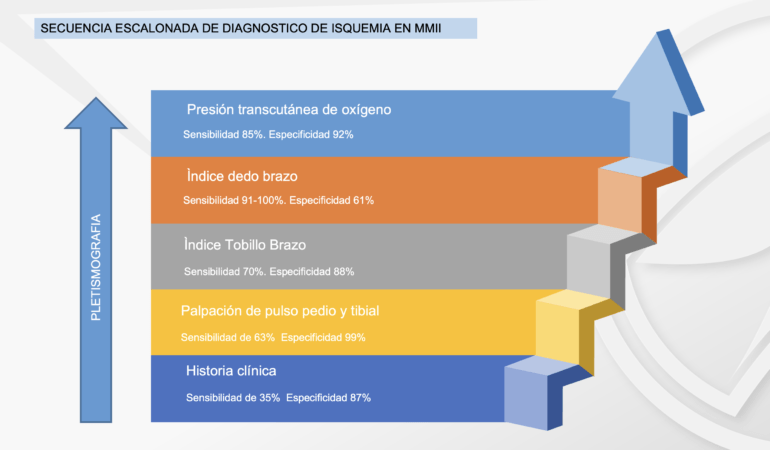
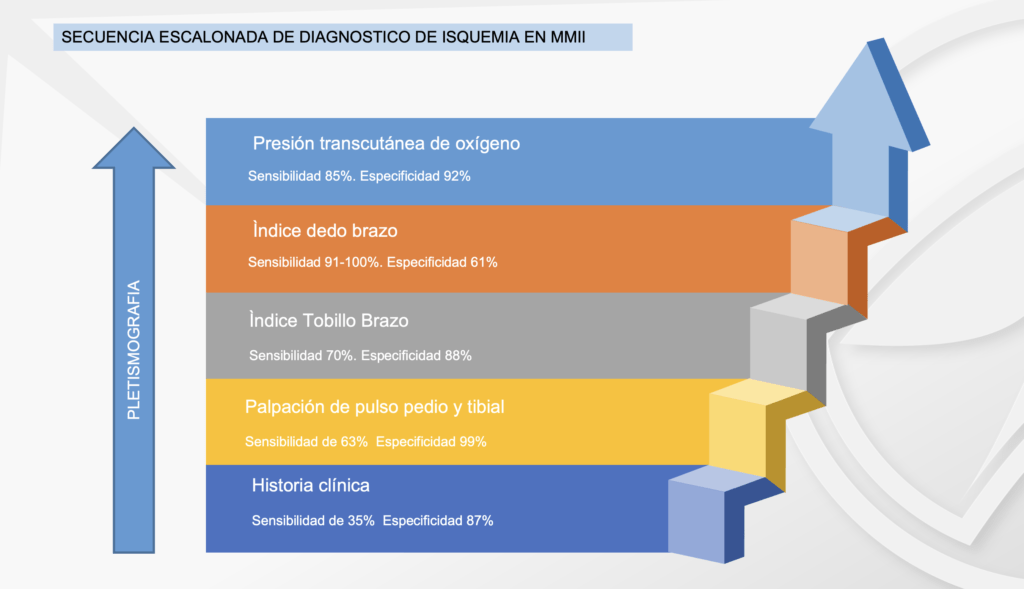
En el caso de los pacientes con isquemia severa, el ataque al pie isquémico debe ser lo más pronto posible, ya que retrasarlo únicamente aumentaría el riesgo de amputación. La evaluación vascular del pie diabético es obligatoria en todos los pacientes, tengan esta úlcera o no, la urgencia de la atención dependerá de la gravedad de la isquemia (en este caso). Algunos autores creen prudente realizar una evaluación escalonada de la enfermedad arterial periférica en los diabéticos, comenzando por la palpación de los pulsos, llegando hasta el IDB(6), nosotros proponemos que donde esté disponible se inicie con el IDB, ya que ahorrará tiempo valioso para el paciente. Desaconsejamos el uso de Doppler arterial para hacer diagnóstico de isquemia en el pie diabético debido a su baja sensibilidad en arterias distales.
1. Organización Mundial de la Salud. INFORME MUNDIAL SOBRE LA DIABETES [Internet]. 2016. Disponible en: www.who.int/diabetes/global-report
2. Herrera G, Lázaro A. El pie diabético en cifras. Apuntes de una epidemia. Rev Médica Electrónica [Internet]. agosto de 2016 [citado 1 de julio de 2019];38(4):514-6. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S1684-18242016000400001&lng=es&nrm=iso&tlng=es
3. Carro GV, Saurral R, Witman EL, Braver JD, David R, Alterini P, et al. ATAQUE DE PIE DIABÉTICO. DESCRIPCIÓN FISIOPATOLÓGICA, PRESENTACIÓN CLÍNICA, TRATAMIENTO Y EVOLUCIÓN. 2020;
4. Edmonds M. Modern treatment of infection and ischaemia to reduce major amputation in the diabetic foot. Curr Pharm Des. 2013;19(27):5008-15.
5. Rincón Y, Gil V, Pacheco J, Benítez I, Sánchez M. Evaluación y tratamiento del pie diabético. Rev Venez Endocrinol Metab [Internet]. octubre de 2012 [citado 5 de octubre de 2023];10(3):176-87. Disponible en: http://ve.scielo.org/scielo.php?script=sci_abstract&pid=S1690-31102012000300008&lng=es&nrm=iso&tlng=es
6. Fermín Rafael Martínez de Jesús. Pie diabético: atención integral [Internet]. 2010 [citado 21 de agosto de 2022]. Disponible en: http://www.ebooks7-24.com/?il=958