Exploración vascular de MMII
Esta pequeña revisión sirve para orientar a los médicos sobre las pruebas necesarias para el estudio de la enfermedad arterial periférica (EAP). Es breve, pero con la intención de dar un poco de luz acerca de cómo orientar el diagnóstico en este tipo de pacientes
¿Qué es EAP?
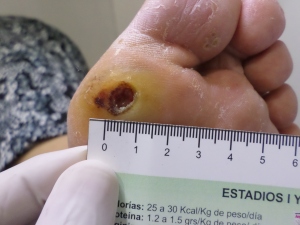
Se define la EAP como todas las enfermedades arteriales excepto las enfermedades de las arterias coronarias y la aorta (1), y no solo de las extremidades inferiores. La aterosclerosis es la causa más frecuente de estrechamiento de las arterias de los MMII, lo que reduce el flujo sanguíneo al miembro al principio durante el ejercicio y a medida existe peoría, llega a cuásar isquemia durante el reposo. Siendo la etapa final de la enfermedad la isquemia crónica que amenaza la extremidad (ICAE)(2), o isquemia crítica (IC).
Durante mucho tiempo se ha utilizado la clasificación de Fontaine y Rutherford como clasificatorios para la EAP, basándose únicamente en la historia clínica, lo que se vuelve ineficiente considerando que la sensibilidad de la historia clínica es solamente del 36%, es decir, dejamos fuera 64% de pacientes con la enfermedad que no presentan signos o síntomas clínicos (3).
¿Cómo se diagnostica la EAP?
El objetivo principal es detectar la enfermedad lo más temprano posible. En los pacientes no diabéticos el índice tobillo brazo sigue siendo el mejor cribaje para detectar la EAP cuando se encuentra debajo de 0.9 (4). En el caso del pie diabético la isquemia es un factor fundamental y puede causar fracaso en el tratamiento, aun cuando se traten efectivamente el resto de los factores como desbridamiento, infección, descarga, etc. La neuropatía en los diabéticos vuelve difícil el diagnóstico de la EAP y de la isquemia crítica (IC), por lo que deben realizarse estudios en todos los pacientes diabéticos sin excepción.
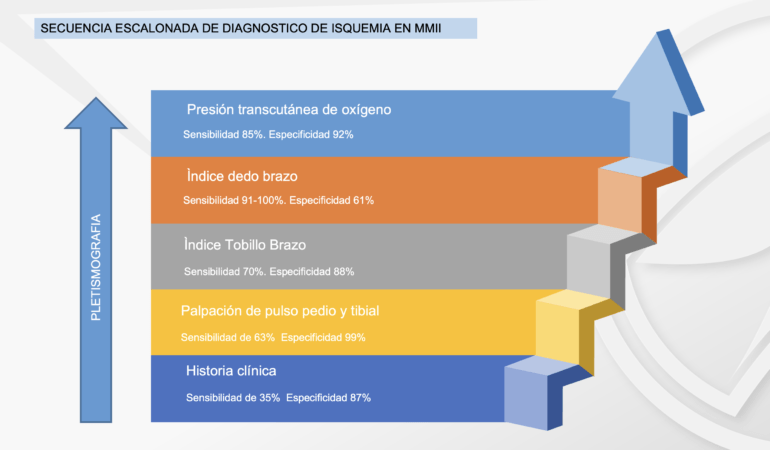
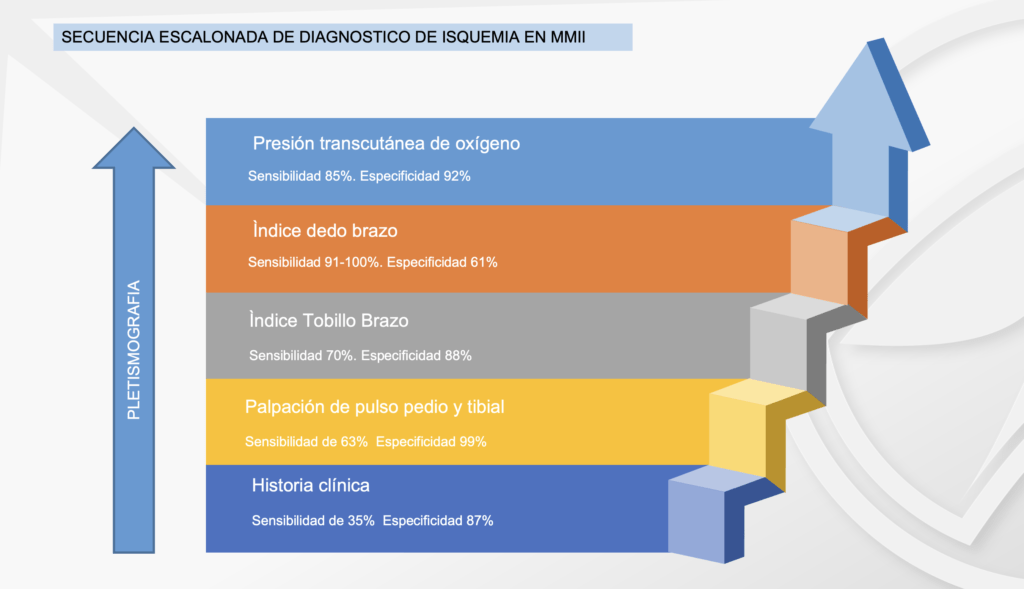
De forma general, el proceso a seguir en los pacientes que se sospecha EAP, y en todos los diabéticos podría ser: 1. Determinar si existe o no isquemia, 2. Que tan grave es y 3. Donde está. Esta es una alteración intencional al orden propuesto por el Dr. Martínez de Jesús (3), ya que nos parece que determinar la gravedad precede a conocer el lugar de la obstrucción, ya que es útil únicamente al momento del tratamiento quirúrgico.
- Palpación de pulsos: la palpación de pulsos es el primer paso, el más barato y rápido para determinar si un paciente presenta EAP o no. Debe realizarse siempre y con todos los pacientes de riesgo, palpando la arteria pedia y tibial posterior de cada pie y anotando si se palpan o no. A nuestro entender, no palpar alguna es indicativo de continuar avanzando en la complejidad de las pruebas. Sensibilidad de 63% y especificidad de 99%
- Índice Tobillo Brazo: estudio mediante Doppler lineal, dividiendo la presión sistólica del pie (en cada una de las arterias) entre la del brazo, dando un cociente ideal de 1, y a medida baja, comienza la EAP, haciendo diagnostico con 0.9 o menos. En los pacientes diabéticos debido a la calcificación de las arterias(5), suele dar un resultado arriba de 1.4, lo que es también diagnóstico de EAP y es necesario pasar al siguiente estudio. El ITB tiene sensibilidad de 71% y especificidad de 88%.
- Índice dedo Brazo/presión en el hálux: mediante el uso de manguitos especiales, es posible tomar la presión en el hálux. Una vez tomada la presión en el hálux, se procede de igual forma a realizar la división entre esa presión y la del brazo, resultando el IDB, el cual varía un poco con respecto al ITB (ver tabla). Este estudio además nos da diagnóstico de isquemia solamente con la presión sistólica (PS) del hálux, pudiendo ser el único estudio necesario para hacer diagnóstico. La sensibilidad del IDB es de 91 a 100% y la especificidad 61%, la presión de dedo tiene sensibilidad de 15% y especificidad de 97%.
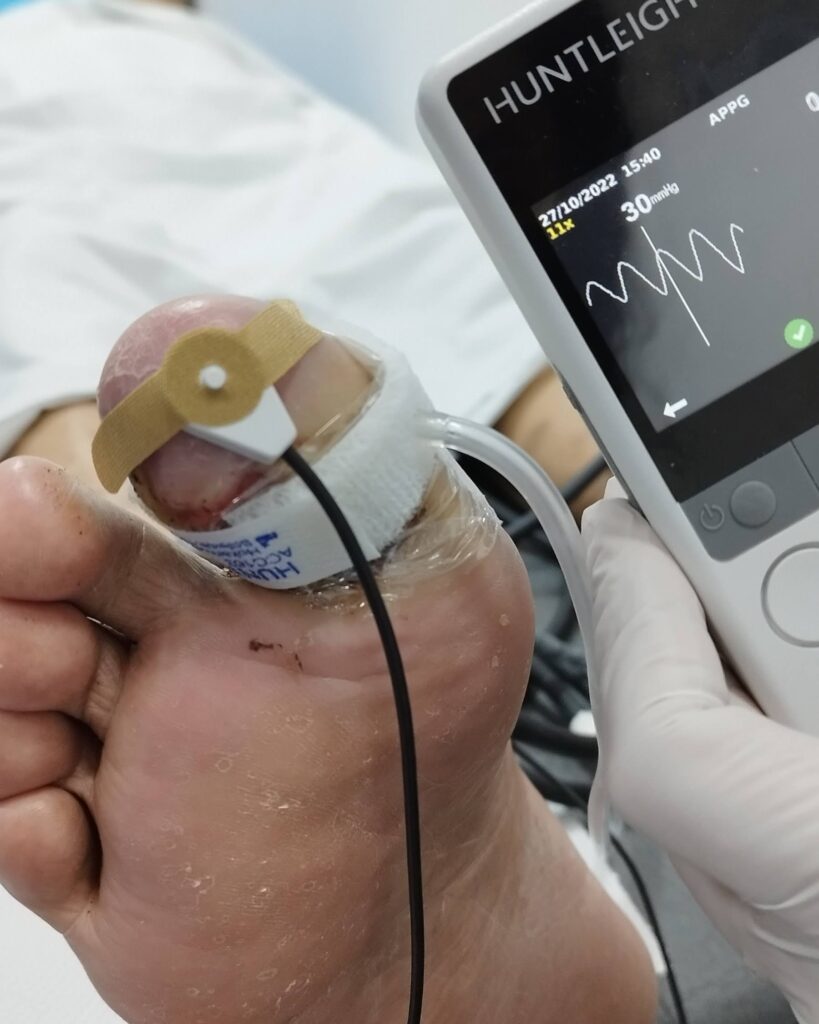
- Pletismografía de onda: la pletismografía es una prueba que puede realizarse en cualquier momento y es mucho más sensible que el ITB, y es necesario realizarlo en las arterias del pie (pedia y tibial posterior) y en el hálux. En el caso de los pacientes diabéticos en los que se ha amputado el primer dedo, la prueba puede realizarse la pletismografía en el segundo dedo.
¿A quién realizarle el cribado?
Independientemente si presentan historia clínica sugestiva o no, deberá buscarse EAP en los siguientes pacientes:
- Varones arriba de 65 años
- Hombres y mujeres arriba de 40 años con factores de riesgo como obesidad, antecedentes familiares de infarto, ACV, EAP
- Diabéticos desde el momento del diagnóstico de la enfermedad
- Tabaquistas independientemente de la edad o de las comorbilidades
- Hipertensos
- Dislipidémicos
- Enfermedad renal crónica en cualquier estadio
- Sedentarios
¿Y el Doppler pulsado arterial?
Esta es una pregunta válida, este estudio sirve únicamente como un localizador de la obstrucción, para ubicar en las arterias el lugar de obstrucción, pero no sirve para hacer diagnóstico de isquemia, así que es debido a eso que no es considerado dentro del protocolo de diagnóstico.
Bibliografía
1. Aboyans V, Ricco JB, Bartelink MLEL, Björck M, Brodmann M, Cohnert T, et al. Guía ESC 2017 sobre el diagnóstico y tratamiento de la enfermedad arterial periférica, desarrollada en colaboración con la European Society for Vascular Surgery (ESVS). Rev Esp Cardiol [Internet]. febrero de 2018 [citado 10 de julio de 2022];71(2):111.e1-111.e69. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0300893217308102
2. Enfermedad Arterial periférica unido.pdf.
3. Mart??nez de Jes??s FR. Pie diab??tico: atenci??n integral [Internet]. 2010 [citado 21 de agosto de 2022]. Disponible en: http://www.ebooks7-24.com/?il=958
4. guia-consenso-enfermedad-arterial-periferica.pdf.
5. AHA Scientifc Statement: Diagnosis and Treatment Chronic Arterial Insufficiency of the Lower Extremities A Critical Review [Internet]. [citado 2 de noviembre de 2022]. Disponible en: https://oce-ovid-com.bibliomedic.proxybk.com/article/00003017-199612010-00095/HTML